Структурна формула гексану: детальний аналіз
Структурна формула гексану є важливим елементом у вивченні органічної хімії, дозволяючим зрозуміти будову та властивості цього нейтралізованого вуглеводню. Гексан, як представник алканів, відіграє значну роль в промисловості, тому розуміння його структурних особливостей є ключовим для хіміків і інженерів.
Що таке гексан?
Гексан – це насичений вуглеводень, який відноситься до класу алканів зі загальною формулою C6H14. Це безбарвна рідина з характерним запахом, яка є основною складовою багатьох розчинників, що використовуються в лабораторіях і промисловості.
Структурна формула гексану
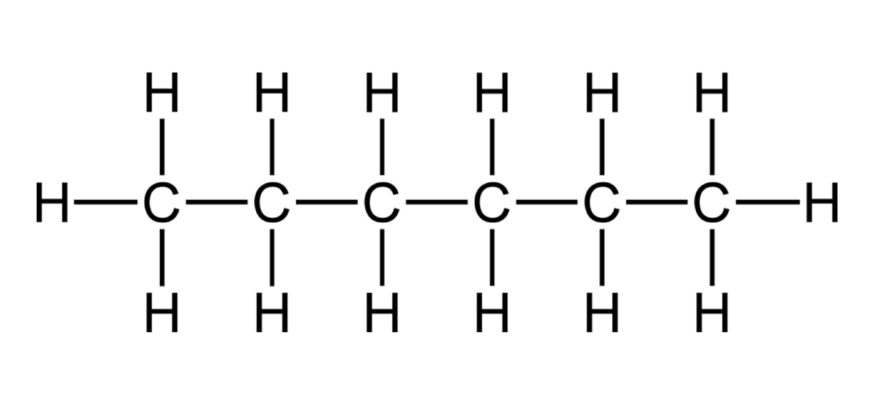
Структурна формула гексану характеризується некриволінійно розміщеними атомами вуглецю, що формують ланцюг з шести атомів. Кожен атом вуглецю з’єднаний з двома сусідніми атомами вуглецю (окрім кінцевих) та має два додаткових водневих атоми, що заповнюють валентність чотири. Це бачимо в наступному відображенні:
- CH3-CH2-CH2-CH2-CH2-CH3
Ізомери гексану
Окрім прямоланцюгового н-гексану, існують ізомери, в яких атоми вуглецю розміщені у розгалуженому порядку. Це такі ізомери:
- 2-метилпентан
- 3-метилпентан
- 2,2-диметилбутан
- 2,3-диметилбутан
Кожен з цих ізомерів має свою унікальну структурну формулу, однак їх загальний склад залишається незмінним: C6H14.
Таблиця властивостей гексану та його ізомерів
| Назва | Структурна формула | Температура кипіння (°C) |
|---|---|---|
| н-гексан | CH3-CH2-CH2-CH2-CH2-CH3 | 69 |
| 2-метилпентан | (CH3)CH-CH2-CH2-CH3 | 60 |
| 3-метилпентан | CH3-CH2-(CH3)CH-CH2-CH3 | 63 |
| 2,2-диметилбутан | CH3-C(CH3)2-CH2-CH3 | 50 |
| 2,3-диметилбутан | CH3-CH(CH3)-CH(CH3)-CH3 | 58 |
Застосування гексану
Гексан та його ізомери знаходять широке застосування в різних галузях:
- Використання у якості розчинника в гумових і текстильних виробництвах.
- Екстракція рослинних олій завдяки здатності розчиняти органічні речовини.
- Компонент у виробництві бензину, оскільки підвищує октанове число пального.
Таким чином, структурна формула гексану забезпечує розуміння як базових характеристик хімічних реакцій, так і їх практичне застосування в промисловості.