Електронна формула оксигену
Електронна формула оксигену є важливим аспектом вивчення хімії, оскільки оксиген (або кисень) є одним з найважливіших хімічних елементів в природі. Він однаково важливий як для живих організмів, що використовують його для дихання, так і для різноманітних хімічних процесів у промисловості.
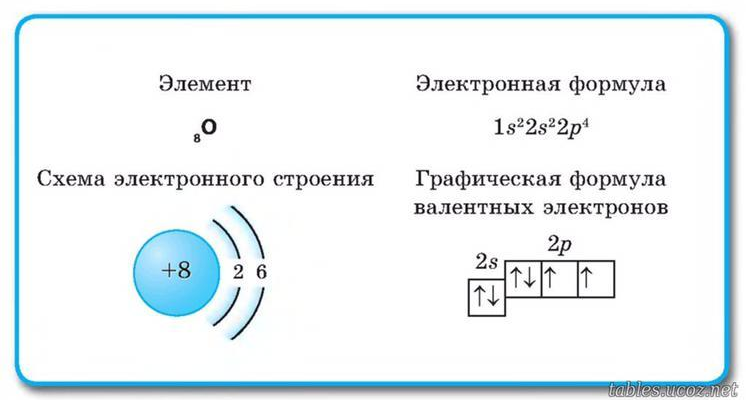
Електронна структура атома оксигену
Оксиген є елементом шостого періоду Періодичної системи хімічних елементів з атомним номером 8. Це означає, що кожен атом оксигену містить вісім електронів. Важливо розуміти розподіл цих електронів по енергетичних рівнях та підрівнях: саме це і є суттю електронної формули.
Розподіл електронів у атомі оксигену
Загальна електронна формула оксигену виглядає наступним чином:
- 1s2
- 2s2
- 2p4
Тепер розгляньмо детальніше, як електрони розподіляються по різних енергетичних рівнях:
- Перший рівень (1s): може містити максимум 2 електрони. У оксигену ця підоболонь заповнена повністю двома електронами, що має вигляд 1s2.
- Другий рівень:
- Підоболонь 2s також заповнюється повністю — 2 електронами — і записується як 2s2.
- Підоболонь 2p може вміщувати до 6 електронів. У атомі оксигену тут розташовано 4 електрони, що записується як 2p4.
Значення електронної формули оксигену
Електронна формула оксигену дозволяє краще зрозуміти хімічну поведінку цього елемента. Завдяки наявності шести електронів на валентних оболонках, оксиген має тенденцію добирати ще два електрони для досягнення стійкої конфігурації, при якій заповнені всі підоболоні на другому рівні (всього вісім електронів). Це обумовлює утворення найбільш характерного для оксигену зарядженого іону з зарядом -2.
Роль у хімічних реакціях
Оксиген активно бере участь у різних окисно-відновних процесах. Його здатність до набуття додаткових електронів робить його потужним оксидатором. Завдяки цьому, він є важливим компонентом у таких реакціях, як горіння та корозія металів.
Електронна формула і молекулярні з’єднання
| Молекула | Формула | Кількість атомів оксигену |
|---|---|---|
| Вода | H2O | 1 |
| Діоксид вуглецю | CO2 | 2 |
Вода (H2O) та діоксид вуглецю (CO2) є прикладами молекул, де оксиген приймає активну участь у хімічних зв’язках. У воді оксиген утворює полярні ковалентні зв’язки з атомами водню, чого не можна не враховувати при вивченні водневих зв’язків. У діоксиді вуглецю оксиген створює два подвійні зв’язки з вуглецем.
Отже, електронна формула оксигену не лише формально описує розподіл електронів навколо атомного ядра, а й забезпечує глибше розуміння його хімічних властивостей та ролі в різноманітних реакціях і процесах.